Tartalom
- irányok
- Az elektronok száma a valencia rétegben
- Lewis-szerkezet
- Minden atom hivatalos töltése
- figyelmeztetés
- Amire szüksége van
A molekula, például a CoCl2 (foszgéngáz) formális töltésének meghatározásakor meg kell ismerni az elektronok számát a molekula minden atomjának valens rétegében és a Lewis szerkezetben.
irányok

-
Keresse meg az elemek időszakos táblázatának minden atomját, hogy meghatározza az elektronok számát a valencia rétegben.
-
Emlékezzünk rá, hogy két elektron van az első alszintben s, kettő a második alszintben, hat elektrón az első p szinten, és így tovább. Visszahívás: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
Hit a terhelés. Ha a molekula ion, akkor adjon hozzá vagy vonjon le egy vagy több elektronot a teljes összegből a végső töltés eléréséhez.
-
CoCl2 (foszgén gáz) esetén: C = 4; O = 6; Cl = 7. A molekula nem ionizált és semleges töltéssel rendelkezik. Ezért a valencia rétegben az összes elektron száma 4 + 6 + (7x2) = 24.
Az elektronok száma a valencia rétegben
-
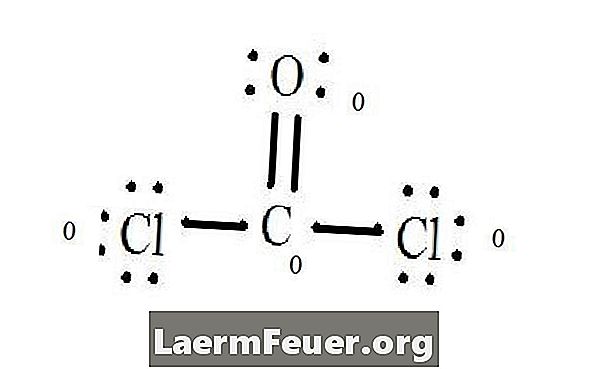
Lásd a CoCl2 (foszgén gáz) Lewis szerkezeti diagramját. A Lewis szerkezet a molekula legstabilabb és legvalószínűbb szerkezete. Atomokat párosított valenciaelektronokkal rajzolnak ki; a szabad elektronok között kötések jönnek létre, hogy kielégítsék az oktett szabályt.
-
Rajzoljunk minden atomot és valenselektronját, majd szükség szerint kötéseket alkossunk.
A Lewis-struktúrán levő elektronok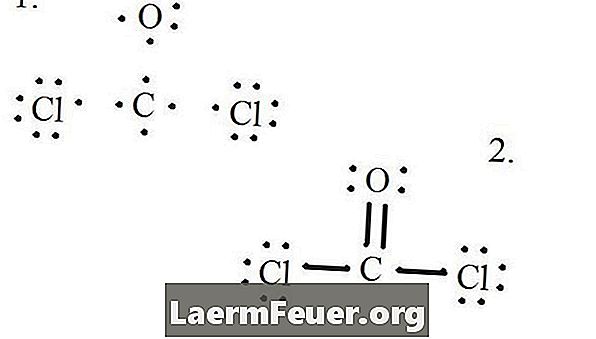
-
A klorid atomok egyetlen kötést kötnek a szénmolekulával, míg az oxigénatom kettős kötést képez a szénnel. A végső szerkezet minden atomja kielégíti az oktett szabályt, és nyolc elektronja van a valencia rétegben, ami lehetővé teszi a molekuláris stabilitást.
Lewis-szerkezet
-
Számítsuk ki az egyes atomok szabad elektronpárjait a Lewis-struktúrában. Minden atom minden egyes kötés elektronját jelöli, amelyből részt vesz. Adja meg ezeket a számokat. CoCl2-ban: C = 0 szabad pár és 4 kötéselektron = 4 elektron. O = 4 szabad elektronpár, plusz 2 elektron kötés = 6 elektron. Cl = 6 db szabad pár elektron és egy elektron egy kötéssel C = 7 elektronnal.
-
A nem kötött atom valens rétegében levő elektronok számát kivonjuk. Az eredmény az egyes atomok hivatalos díja. A CoCl2-ban: C = 4 valenciaelektron (ev) a nem kötött atomban, mínusz 4 elektron, a Lewis struktúrában (LS) = 0 formális töltés O = 6 ev - 6 LS = 0 formális töltés Cl = 7 és - 7 LS = 0 hivatalos díj
Az atomok hivatalos töltése
-
Íráskor helyezze ezeket a díjakat a Lewis-struktúra atomjainak közelébe. Ha a molekulának összesen töltése van, akkor a Lewis struktúrát zárójelben helyezze el a jobb felső sarokban lévő külső töltéssel.
Minden atom hivatalos töltése
figyelmeztetés
- Az átmenetifémeket tartalmazó molekulák hivatalos töltésének kiszámítása áruló lehet. Az átmeneti fémek valens rétegében az elektronok száma a nemesgázmintából lesz.
Amire szüksége van
- Az elemek időszakos táblázata