Tartalom
- Az elektronok száma a vegyértékhéjban
- 1. lépés
- 2. lépés
- 3. lépés
- 4. lépés
- Lewis szerkezete
- 1. lépés
- 2. lépés
- 3. lépés
- Az egyes atomok formális töltése
- 1. lépés
- 2. lépés
- 3. lépés
Egy olyan molekula formális töltésének meghatározásakor, mint a CoCl2 (foszgéngáz), ismerni kell az egyes atomok vegyértékrétegében lévő elektronok számát és a molekula Lewis-szerkezetét.
Az elektronok száma a vegyértékhéjban
1. lépés
Keresse meg az egyes atomokat a periódusos rendszerben, hogy meghatározza az elektronok számát a vegyértékhéjban.
2. lépés
Ne felejtsük el, hogy két elektron az első s alszintnél, kettő a második s alszintnél, hat elektron az első p alszintnél stb. Ne feledje: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
3. lépés
Üsse be a terhelést. Ha a molekula ion, akkor adjunk hozzá vagy vonjunk ki egy vagy több elektront az összesből, hogy elérjük a végső töltést.
4. lépés
CoCl2 (foszgéngáz) esetén: C = 4; O = 6; Cl = 7. A molekula nem ionizált és semleges töltéssel rendelkezik. Ezért a vegyértékhéjban az elektronok száma 4 + 6 + (7x2) = 24.
Lewis szerkezete
1. lépés
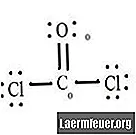
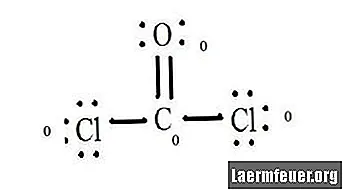
Lásd a CoCl2 (foszgéngáz) Lewis-szerkezetének diagramját. A Lewis-szerkezet képviseli a molekula legstabilabb és legvalószínűbb szerkezetét. Az atomokat párosított vegyérték elektronokkal húzzák meg; a szabad elektronok között kötések alakulnak ki az oktett szabály kielégítésére.
2. lépés

Rajzolja meg az egyes atomokat és azok vegyértékelektronjait, majd szükség szerint kötéseket alakítson ki.
3. lépés
A kloridatomok egyszerű kötéseket kötnek a szénmolekulával, míg az oxigénatom kettős kötést képez a szénnel. A végső szerkezet minden egyes atomja megfelel az oktett szabálynak, és a vegyértékes héjban nyolc elektron van, ami lehetővé teszi a molekuláris stabilitást.
Az egyes atomok formális töltése
1. lépés
Számolja meg a Lewis-struktúra egyes atomjainak elektronmentes párjait. Minden atomhoz hozzárendelnek egy elektront minden olyan kötésből, amelyben részt vesz. Adja hozzá ezeket a számokat. CoCl2-ben: C = 0 szabad pár plusz 4 elektron kötés = 4 elektron. O = 4 szabadpár páros elektronja plusz 2 kötés elektron = 6 elektron. Cl = 6 szabad pár elektron, plusz egy C = 7 elektron kötés elektronja.
2. lépés
Vonjuk le a nem kötött atom vegyértékhéjában lévő elektronok számát. Az eredmény az egyes atomok hivatalos töltése. CoCl2-ben: C = 4 vegyérték elektron (ev) a meg nem kötött atomban, mínusz 4 Lewis-struktúrában kijelölt elektron (LS) = 0 formális töltés O = 6 ev - 6 LS = 0 formális töltés Cl = 7 ev - 7 LS = 0 hivatalos rakomány
3. lépés
Írás közben helyezze ezeket a töltéseket az atomok közelébe a Lewis-struktúrában. Ha a molekulának összesen van töltése, zárójelbe tegye a Lewis-szerkezetet, a jobb felső sarokban pedig a kívülre írt töltéssel.